O uso inteligente de dois anticorpos monoclonais (MoAb) humanizados
James Fleck, MD, PhD: Conexão Anticâncer 01 (05), 2021
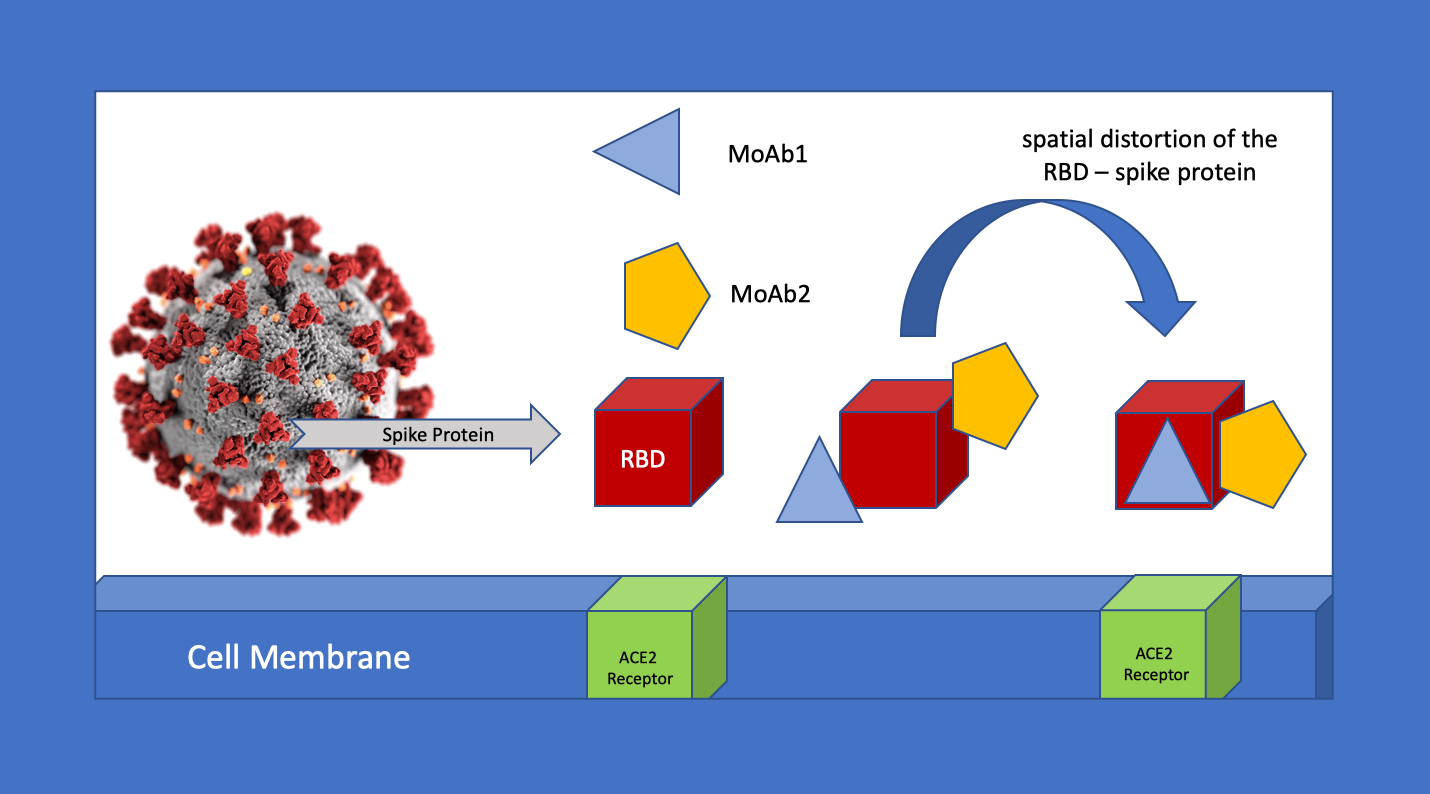
O mecanismo biológico da infecção devida ao SARS-COV2 é bem conhecido. A proteína spike presente na superfície do SARS-COV2 utiliza seu RBD (Receptor Binding Domain) e liga-se ao receptor da enzima conversora de angiotensina-2 (ACE2) encontrado na membrana da célula alvo do hospedeiro. Anticorpos monoclonais humanizados altamente potentes foram desenvolvidos para ligar-se a epítopos específicos não sobrepostos presentes no RBD da proteína spike viral. O uso combinado de dois anticorpos monoclonais neutralizantes de alta afinidade pode ser um tratamento eficaz contra COVID-19. A estratégia também poderia proteger contra o surgimento de resistência devido à mutação viral eventualmente induzida por pressão seletiva associada a tratamentos com um único MoAb. O bloqueio duplo com MoAb causaria uma distorção espacial da proteína spike, tornando-a não mais adequada para promover a ligação efetiva ao receptor ACE2. Isso diminuiria a capacidade do vírus de entrar na célula-alvo, o que poderia ser medido pela redução da carga viral do hospedeiro. A figura abaixo é um esboço artístico rudimentar para ilustrar o raciocínio que sustenta o duplo bloqueio com MoAb.
Recentemente, a Regeneron Pharmaceuticals - Roche lançaram o REGEN-COV, um coquetel composto por casirivimab (REGN10933) e imdevimab (REGN10987), MoAb direcionados a epítopos diferentes e não sobrepostos do RDB da proteína spike do SARS-COV2. Os MoAb foram desenvolvidos a partir de camundongos humanizados e soros de pacientes recuperados de COVID-19, mostrando ligação de alta afinidade (Kd = 37,1 a 42,8 pM) em ensaios de ligação competitiva. Espectrometria de massa (HDXMS) e microscopia crioeletrônica de partícula única foram usadas, revelando onde cada MoAb contata a superfície do RDB. Um mapa de reconstrução tridimensional (3D) mostrou que o casirivimab (REGN10933) se liga no topo do RDB, sobrepondo-se extensivamente ao sítio de ligação para ACE2, enquanto o epítopo para imdevimab (REGN10987) está localizado ao lado do RBD, longe do epítopo para REGN10933 e tem pouca ou nenhuma sobreposição com o local de ligação ACE2. O uso combinado de casirivimab e imdevimab causou citotoxicidade mediada por anticorpos e fagocitose celular em células infectadas por vírus in vitro. Usando modelos animais programados, REGEN-COV foi associado a uma diminuição na carga viral, bem como uma redução na incidência e gravidade da doença pulmonar, quando comparado ao placebo. Um ensaio clínico acelerado de fase I, II e III controlado por placebo foi conduzido em pacientes sintomáticos não hospitalizados nos 3 dias após o diagnóstico molecular positivo e nos 7 dias após os primeiros sintomas. O uso combinado de casirivimab e imdevimab foi associado a uma redução significativa (P <0,0001) na carga viral basal (-0,36 log10 cópias / ml), especialmente obtida em pacientes que apresentavam carga viral mais elevada e que eram soronegativos no início do estudo. Além disso, um número menor de pacientes tratados com a combinação de MoAb tiveram hospitalizações relacionadas ao COVID-19 ou visitas a serviços de emergência (H-VSE). A redução do risco absoluto foi mais pronunciada em pacientes com comorbidades (H-VSE foi de 3% no tratamento com MoAb versus 9% com placebo. Em 10 de março de 2021, a Eli Lilly and Company anunciou o uso combinado de dois MoAb, bamlanivimab e etesevimab contra SARS-CoV2. O tratamento precoce de pacientes ambulatoriais de alto risco COVID-19 com bamlanivimab combinado e etesevimab diminuiu significativamente a carga viral em comparação com placebo no período compreendido entre o dia 3 e o dia 11. No ensaio de fase III controlado por placebo, o uso combinado de bamlanivimab e etesevimab foi associado a 70 % de redução na hospitalização e morte relacionadas com COVID-19.
Os quatro MoAb estão entre os anticorpos neutralizantes de SARS-CoV2 mais potentes em uso ou em desenvolvimento clínico. No entanto, têm surgido preocupações sobre sua eficácia contra a variante P1 brasileira, o que aumenta a importância de uma cobertura vacinal completa da população.
Referências:
1. Jun Lan, Jiwan Ge, Jinfang Yu, et al: Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor, Nature 581: 215-220, May 14th, 2020
2. Johanna Hansen, Alina Baum, Kristen E. Pascal, et al: Studies in humanized mice and convalescent humans yield a SARS-CoV-2 antibody cocktail, Science 369, 1010–1014, August 21st, 2020
3. Zhiqiang Ku, Xuping Xie, Edgar Davidson, et al: Molecular determinants and mechanism for antibody cocktail preventing SARS-CoV-2 escape, Nature Communications, 2021 (https://doi.org/10.1038/s41467-020-20789-7)
4. Peter C. Taylor, Andrew C. Adams, Matthew M. Hufford, et al: Neutralizing monoclonal antibodies for treatment of COVID-19, Nature Reviews – Immunology, 2021
5. Alina Baum, Benjamin O. Fulton, Elzbieta Wloga, et al: Antibody cocktail to SARS-CoV-2 spike protein prevents rapid mutational escape seen with individual antibodies, Science 10.1126 science.abd0831, 2020
6. Roche Communication: New phase III data shows investigational antibody cocktail casirivimab and imdevimab reduced hospitalization or death by 70% in non-hospitalized patients with COVID-19, March 23rd, 2021
7. D.M. Weinreich, S. Sivapalasingam, T. Norton, et al: REGN-COV2, a Neutralizing Antibody Cocktail, in Outpatients with Covid-19, N Engl J Med 384:238-51, 2021
8. Eli Lilly Communication: Lilly's bamlanivimab and etesevimab together reduced hospitalizations and death in Phase 3 trial for early COVID-19, March 10th, 2021
9. Pengfei Wang, Ryan G. Casner, Manoj S. Nair, et al: Increased Resistance of SARS-CoV-2 Variant P.1 to Antibody Neutralization, bioRxiv, version posted April 9, 2021, DOI: https://doi.org/10.1101/2021.03.01.433466

A crise mundial causada pelo Sars-CoV 2 resultou em tremendos esforços mundiais a fim de desenvolver vacinas e tratamentos eficientes contra a doença. Nesse contexto, a terapia com anticorpos monoclonais, que vem revolucionando o tratamento de uma série de doenças, parece ser um promissor meio para se atingir um tratamento efetivo contra o vírus. No entanto, é valido ressaltar que o custo desse tipo de terapia é bastante alto, de forma que, mesmo com resultados positivos de sua eficácia, muito dificilmente será uma terapia que seja passível de se aplicar em massa na rede pública de saúde.
Anticorpos monoclonais são utilizados para tratar doenças como o câncer e no atual contexto está sendo verificada se há benefício da utilização desse tipo de medicamento para o tratamento da Covid-19. O desenvolvimento de tratamentos associados a vacinação da população são importantes para que possamos superar a crise mundial causada pelo Sars-Cov 2. Um ponto importante a ser discutido é o custo que esse tratamento terá para a população, uma vez que é sabido que anticorpos monoclonais são medicamentos que possuem um preço elevado.
Em um ano de pandemia, a ciência tem se esforçado de maneira incansável na busca por tratamentos eficazes contra a covid-19. Nesse contexto, o artigo apresentou dados muito promissores em relação ao uso de anticorpos monoclonais no tratamento de pacientes infectados pelo vírus Sars-cov-2. No entanto, penso que seria interessante ressaltar que hoje em dia o acesso as terapias com anticorpos monoclonais é restrito devido ao preço desses tratamentos. Trazendo para o contexto brasileiro, mais precisamente ao SUS, penso que seria difícil garantir o acesso pleno da população.
Interessante editorial, e mostra um caminho promissor para o tratamento da COVID. Anticorpos são uma maneira eficiente e rápida para o tratamento de doenças virais, com um desenvolvimento acelerado com as novas tecnologias de produção de anticopos, tal como "phage display". O grande desafio é identificar sítios virais importantes na virulência. Acredito que a produção de anticorpos que atuem nos receptores de ACE2 tem se mostrado o caminho mais lógico para tratamentos promissores, principalmente por impedir a entrada do vírus sars-cov-2 nas células, também é uma região altamente conservada, o que acarreta numa segurança para a aplicação de medicamentos contra as novas variantes.
Interessante editorial, e mostra um caminho promissor para o tratamento da COVID. Anticorpos são uma maneira eficiente e rápida para o tratamento de doenças virais, com um desenvolvimento acelerado com as novas tecnologias de produção de anticopos, tal como "phage display". O grande desafio é identificar mesmo sítios virais importantes na virulência. Acredito que a produção de anticorpos que atuem nos receptores de ACE2 tem se mostrado o caminho mais lógico para tratamentos promissores, principalmente por impedir a entrada do vírus sars-cov-2 nas células, também é uma região altamente conservada, o que acarreta numa segurança para a aplicação de medicamentos contra as novas variantes.
O texto discute o uso de anticorpos monoclonais humanizados como uma estratégia eficaz contra a COVID-19. O uso de dois anticorpos monoclonais direcionados a epítopos diferentes e não sobrepostos da proteína spike viral pode ser particularmente eficaz, evitando a resistência à mutação viral eventualmente induzida por pressão seletiva associada a tratamentos com um único anticorpo. A combinação de MoAb casirivimab e imdevimab foi associada a uma diminuição na carga viral e uma redução na incidência e gravidade da doença pulmonar em pacientes sintomáticos não hospitalizados. O uso combinado de bamlanivimab e etesevimab também foi associado a uma redução significativa na carga viral e uma redução na hospitalização e morte relacionadas ao COVID-19 em pacientes ambulatoriais de alto risco. Os quatro MoAb são considerados entre os anticorpos neutralizantes de SARS-CoV2 mais potentes em uso ou em desenvolvimento clínico. Logo, vê-se a importância e eficácia do uso de anticorpos monoclonais no contexto clínico.
Faça o login para escrever seu comentário.
Se ainda não possui cadastro no Portal Conexão Anticâncer, registre-se agora.