Opções terapêuticas usando nanotecnologia
James Fleck, MD, PhD and Emily Tonin da Costa, MD: Conexão Anticâncer 9 (05), 2022
Dados do Global Cancer Observatory, indicam o câncer de mama como a principal neoplasia maligna em mulheres, atingindo uma incidência global de quase 2,3 milhões (ASR = 47,8) no mais recente relatório anual da Agência Internacional de Pesquisa sobre o Câncer (IARC). Atualmente, o câncer de mama é também a principal causa de mortalidade por doença maligna em mulheres em todo o mundo, conduzindo a aproximadamente 685.000 mortes, anualmente. Esses dados epidemiológicos globais conferem ao câncer de mama um risco de letalidade aparente de 29,8%. No Brasil e nos EUA, esta taxa de letalidade aparente cai para 23,4% e 16,8%, respectivamente. Nos Estados Unidos, até 5% das mulheres diagnosticadas com câncer de mama já têm doença metastática por ocasião da apresentação da doença e até 30% das pacientes com câncer de mama diagnosticadas em estágios iniciais irão desenvolver doença metastática. No Brasil, esses números são piores, o que é responsável pela diferença observada na taxa de letalidade aparente, entre os dois países. No mundo, aproximadamente 20% dos tumores de mama revelam superexpressão o receptor 2 do fator de crescimento epidérmico humano (Her2), uma glicoproteína transmembrana que induz a atividade da tirosina quinase. Para uma melhor compreensão da ativação e dimerização do receptor Her2 acesse o link abaixo. A superexpressão de Her2 está associada a um risco aumentado de recorrência da doença e a um pior prognóstico. Embora o câncer de mama metastático Her2-positivo seja uma doença incurável, sobrevida prolongada vem sendo alcançada com o duplo bloqueio Her2. Inicialmente, foi desenvolvido o trastuzumab, que se liga ao domínio extracelular do receptor Her-2, promovendo citotoxicidade e redução independente da proliferação celular. Posteriormente, foi identificado o pertuzumab, ligando-se a um epítopo distinto (subdomínio II) do domínio extracelular do receptor Her-2. A ação impediu a dimerização do receptor, levando ao comprometimento da função das células tumorais. O uso combinado de dois AcMo foi avaliado por um estudo prospectivo aleatório de fase III chamado CLEOPATRA. A diferença na SG mediana, favorecendo o duplo bloqueio (pertuzumab + trastuzumab + docetaxel) foi de 16,3 meses, quando comparado ao braço controle (placebo + trastuzumab + docetaxel). Após 8 anos de acompanhamento, uma análise histórica da população com intensão de tratar, constituída por mulheres com câncer de mama avançado Her-2 positivo submetidas a duplo bloqueio, mostrou uma sobrevida global sem precedentes de 37%, levando ao conceito de cronificação da doença. Apesar dos resultados encorajadores do estudo CLEOPATRA, a maioria das pacientes com câncer de mama metastático Her2-positivo irá progredir após o duplo bloqueio.
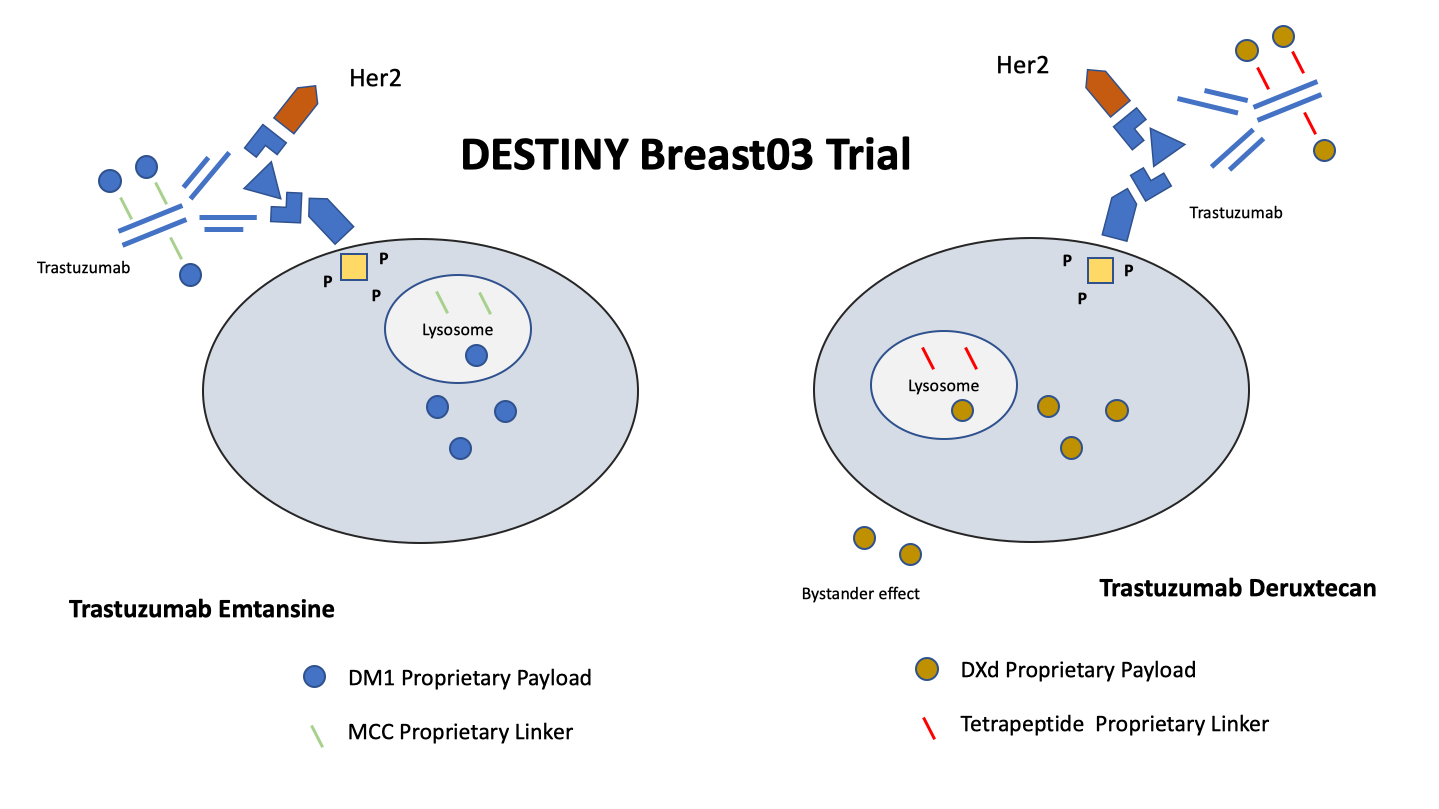
A questão seguinte é: qual tratamento deve ser utilizado após a progressão com duplo bloqueio? A nanotecnologia, usando conjugado anticorpo-droga (ADC), veio como uma alternativa muito promissora. Aqui, o trastuzumab, um AcMo anti-Her2 é combinado a um medicamento citotóxico, denominado proprietary payload por meio de um proprietary drug linker passível de clivagem. Trastuzumab é muito específico na identificação de células do câncer de mama Her2-positivas, dirigindo o ADC para o alvo biológico. O complexo permanece estável na circulação, evitando a liberação sistêmica, inespecífica e indesejável da quimioterapia. Finalmente, o complexo é endocitado e fundido com um lisossomo, onde sofre degradação proteolítica, liberando finalmente sua proprietary payload (quimioterapia). Eventualmente, há também um bystander effect, pois as células vizinhas Her2-negativas também são expostas à citotoxicidade, presumivelmente devido a sua permeabilidade transmembrana e, portanto, à difusão intercelular da carga útil. Duas iniciativas concorreram, sequencialmente, nesse cenário terapêutico. Primeiro, surgiu o trastuzumab emtansine (TDM-1), que é um ADC composto de trastuzumab, ligado de forma estável ao DM1 (proprietary payload). T-DM1 carrega uma média de 3,5 moléculas de DM1 por cada molécula de trastuzumab. Cada molécula de DM1 é conjugada com trastuzumab através do MCC (proprietary drug linker), que é um ligante tioéter não redutível N-succinimidil-4-(N-maleimidometil) ciclohexano-1-carboxilato. O DM1 tem um mecanismo de ação semelhante aos alcaloides da vinca, mas 100 vezes mais potente. Outro medicamento promissor é o trastuzumab deruxtecan. Este ADC combina trastuzumab com DXd, um inibidor citotóxico da topoisomerase I (proprietary payload), usando um ligante à base de tetrapeptideo passível de clivagem (proprietary drug linker). Após a ligação às células do câncer de mama Her2-positivas, o trastuzumab deruxtecan sofre internalização e clivagem intracelular por enzimas lisossômicas. Após ser liberado, o DXd causa danos ao DNA e morte celular por apoptose. O DXd citoplasmático apresenta permeabilidade transmembrana, sendo também eficaz em destruir células de câncer de mama vizinhas Her2-negativas (bystander effect).
Em março de 2022, o New England Journal of Medicine publicou o estudo DESTINY-Breast03, um estudo aleatório de fase III, multicêntrico, aberto, comparando a eficácia e a segurança dos dois tratamentos ADC atualmente disponíveis para câncer de mama avançado. Um total de 524 pacientes com câncer de mama avançado Her2-positivo que progrediram durante ou após trastuzumab + taxano foram aleatoriamente designados 1:1 para receber trastuzumab emtansine ou trastuzumab deruxtecan. O desfecho primário foi a sobrevida livre de progressão (SLP) e os desfechos secundários incluíram sobrevida global, resposta objetiva e segurança. A SLP em 12 meses, foi significativamente maior (HR = 0,28, P <0,001) utilizando trastuzumab deruxtecan (75,8%) versus trastuzumab emtansine (34,1%). Apesar de um limite significativo pré-especificado não ter sido atingido, a percentagem de pacientes vivos em 12 meses foi maior no braço de trastuzumab deruxtecan (94,1%) do que no braço de trastuzumab emtansine (85,9%). Um seguimento mais longo será necessário para avaliar melhor a sobrevida global mediana. Houve maior toxicidade grau 3 ou 4 associada ao trastuzumab deruxtecan (45,1%) do que ao trastuzumab emtansine (39,8%). Gerou preocupação, a doença pulmonar intersticial relacionada ao medicamento ou pneumonite, ocorrendo em 10,5% das mulheres tratadas com trastuzumab deruxtecan.
Em maio de 2022, a Food and Drug Administration (FDA) dos EUA aprovou o trastuzumab deruxtecan para pacientes com câncer de mama avançado Her2-positivo previamente tratados e que progrediram no cenário metastático ou dentro de 6 meses após o tratamento neoadjuvante. A revisão foi conduzida no âmbito do Projeto Orbis, que fornece uma estrutura para submissão e revisão simultânea de medicamentos oncológicos entre parceiros internacionais. No entanto, outras revisões de submissão podem estar em andamento em agências reguladoras. Ao pedido foi concedido Revisão Prioritária, designação de Terapia Inovadora e designação de Medicamento Órfão.
Link: (https://anticancerweb.com/educacao/when-a-clinical-trial-turns-into-a-win-win-game)
ASR = Age-standardized Rate, IARC = International Agency for research on Cancer, AcMo = Anticorpo Monoclonal, SG = Sobrevida Global, ADC = Antidrug Conjugate, SLP = Sobrevida Livre de Progressão
Referências:
1. Global Cancer Observatory: International Agency for Research on Cancer (IARC), World Health Organization, 2020
2. Natalia V. Sergina and Mark M. Moasser: The HER family and cancer: emerging molecular mechanisms and therapeutic targets, Trends Mol Med, 13(12): 527–534, 2007
3. Thuy Vu and Francois X. Claret: Trastuzumab: updated mechanisms of action and resistance in breast cancer, Frontiers of Oncology 2 (62), 2012M.
4. Capelan, L. Pugliano, E. De Azambuja, at al: Pertuzumab: new hope for patients with HER2-positive breast cancer, Annals of Oncology 24: 273–282, 2013
5. Swain SM, Miles D, Kim SB, et al: Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol 21:519, 2020
6. Cortés J, Kim SB, Chung WP, et al: Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med 386:1143, 2022
7. FDA Grants Regular Approval to Fam-Trastuzumab Deruxtecan-nxki for Unresectable or Metastatic Her2-positive Breast Cancer, The ASCO Post, 5/5/2022 11:15:40 AM, 2022

O trastuzumab é, sem dúvidas, um grande aliado no tratamento de câncer de mama avançado Her2-positivo. Diversos estudos o apontam como uma medicamento eficaz, capaz de controlar a progressão do tumor.
Atualmente, muito mais do que simplesmente a cura a qualquer preço, os pacientes desejam ter qualidade de vida. O desenvolvimento de AcMo associados à quimioterápicos é útil nesses casos, pois promove uma boa resposta terapêutica e diminui os efeitos adversos, pois é o tratamento é mais específico/direcionado.
Preciso confessar que fico fascinado com a complexidade e com a genialidade do desenvolvimento e da formação tumoral! Apesar de a doença carregar um estigma muito pesado (e com bastante mérito!), não podemos negar que as tecnologias dos anticorpos monoclonais, dos quimioterápicos e dos demais métodos terapêuticos, conseguiram alterar desfechos de morte eminente para a cronificação da doença. Tudo isso permitiu que o paciente oncológico tivesse mais tempo, mais conforto e mais qualidade de vida. Incrível!
A nanotecnologia revolucionou o tratamento do CA de mama e o prognóstico de muitos pacientes. Fica para nós o desafio de se empenhar para que novas descobertas sejam feitas para o tratamento de outros tipos de tumor.
O avanço no tratamento do câncer de mama se deve ao excelente trabalho dos profissionais que buscam melhorar a qualidade de vida dos pacientes que sofrem não só da doença em si, mas da toxicidade dos fármacos utilizados na quimioterapia. Os pacientes buscam mais tempo e qualidade de vida, e o tratamento com os AcMo associados à quimioterápicos pôde promover isso, por meio de um tratamento mais específico e com menos efeitos adversos.
O tratamento para o câncer vêm ocorrendo um grande progresso, e agora, cada vez mais aliado a tecnologia, podemos ter perspectivas melhores. Permitindo oferecer ao paciente, uma maior qualidade de vida durante esse processo.
A ciência tem permitido que o câncer seja controlado por anos, mesmo nos casos em que a cura não faz parte do prognóstico. A tecnologia de produção de anticorpos monoclonais recombinantes tem revolucionado o tratamento para o C.A, possibilitando um tratamento mais específico, que melhora sobrevida e oferece mais conforto e qualidade ao paciente oncológico, já que possui alta especificidade, seletividade e afinidade ao tecido alvo, minimizando as reações adversas.
O câncer de mama é muito prevalente e marcadores de crescimento tumoral HER2 são importantes para o prognóstico e indicação de crescimento celular. Com o passar dos anos, as terapias disponíveis estão mais alcançáveis e há terapias alvo que é um tratamento específico e que diminui efeitos adversos que uma quimioterapia citotóxica proporcionaria.
When it is Her2+, it is preferably treated with targeted therapy and when negative, it can be treated with standard chemotherapy. Studies like this are important for the development of new treatments.
É realmente reconfortante constatar que houve uma série de avanços promissores no tratamento de um dos cânceres mais prevalentes no mundo. As neoplasias mamárias têm sido muito bem mitigadas por meio da nanotecnologia, sobretudo no que diz respeito aos anticorpos monoclonais recombinantes. Nesse âmbito, o trastuzumab e outros compostos derivados dele ganham destaque por demonstrar controle eficaz da progressão tumoral em pacientes que superexpressam o receptor Her2. Vale ressaltar que, mesmo tratando-se de um tumor incurável, a melhora da sobrevida dos pacientes é uma meta atingível e deveras significativa.
O trastuzumabe mostrou-se um grande aliado no tratamento de câncer de mama avançado Her2-positivo, permitindo á paciente não só a cura, mas também qualidade de vida. O avanço no tratamento do câncer é mérito de todos os profissionais da área da pesquisa dispostos a ajudar milhões de mulheres que passam por essa doença.
O câncer, antes visto como uma sentença de morte, progressivamente altera seu prognóstico para uma doença crônica em decorrência dos avanços no conhecimento da biologia molecular das neoplasias e do desenvolvimento de novas terapias baseadas nessas descobertas. Um importante exemplo disso são as terapias alvo para câncer de mama com superexpressão de HER-2, o qual, apesar de conferir um pior prognóstico, apresenta um potencial alvo terapêutico, viabilizando o aumento da sobrevida de pacientes outrora com dias contados.
Apesar do grande avanço no tratamento e diagnóstico do câncer de mama, ainda é muito impactante observar que essa malignidade é responsável por aproximadamente 685.000 mortes anuais e possui um risco de letalidade aparente de 29,8%. Nesse sentido, ainda fica bastante evidente que podemos avançar em muito na prevenção de morte por câncer de mama. Entretanto, a oncologia constantemente avança em terapias que buscam modificar a história natural da doença, por exemplo, as terapias que envolvem o duplo bloqueio do Her-2. Apesar do tratamento atual ainda não garantir a cura, é evidente que a sobrevida geral, fator importantíssimo para esses pacientes, aumentou consideravelmente em um cenário que antes provavelmente se apresentaria como uma morte certeira.
É muito interessante observar como a tecnologia em Medicina avançar cada vez mais, fazendo com que tratamentos cada vez mais eficazes sejam disponibilizados para doenças que antes não contavam com nenhum tratamento ou com tratamento ineficaz. O ADC (conjugado anticorpo-droga) ilustra muito bem esse cenário e tem grande potencial.
O antigo imperador de todos os males, o câncer, vem alterando seu prognóstico e muitas vezes passando a ser encarado como uma doença crônica em decorrência dos avanços tecnológicos da medicina. Ainda assim, o câncer de mama, ainda é responsável por mais de 600 mil mortes por ano. O trastuzumab vem como um grande aliado no tratamento do câncer de mama avançado (Her2 +) e esperamos que mais drogas como essa possam ser adicionadas ao arsenal de tratamento das neoplasias
O desenvolvimento de anticorpos conjugado-droga são um exemplo fenomenal do avanço tecnológico da última década, sobretudo na pesquisa em nanotecnologia, bem como representam uma esperança para o desenvolvimento de novas terapias com eficácia e segurança muito superiores em relação às terapias atuais. Com o maior desenvolvimento dessas tecnologias, a perspectiva do tratamento do câncer parece ser muito promissora.
A nanotecnologia é uma área em crescimento que pode proporcionar as ferramentas necessárias para permitir o desenvolvimento de novos diagnósticos, tratamentos e prevenções para diferentes tipos de câncer. O uso dessa tecnologia pode mudar desfechos e melhorar a qualidade de vida dos pacientes, por isso fica claro a importância de existirem investimentos em pesquisas nessa área.
Atualmente, novas evidências científicas fazem possível o combate contra o câncer uma luta mais justa. Com o desenvolvimento de novas formas de tratamento, especialmente as terapias alvo, assim como conjugado anticorpo-droga, um método ainda mais inovador, podemos outorgar novas oportunidades a mulheres com câncer de mama, inclusive as que apresentam uma doença mais agressiva e metastática.
É surpreendente que o câncer de mama ainda seja responsável por milhares de mortes, com um risco de mortalidade alto, apesar dos grandes progressos no tratamento e diagnóstico. Embora o tratamento atual ainda não garanta a cura, a oncologia está incessantemente avançando em terapias que buscam alterar a história natural da doença e é evidente que a sobrevida global tem aumentado consideravelmente com isso.
O câncer de mama vem ao longo dos anos sendo luta para os cientista em prol de tratamentos curativos. A nanotecnologia trouxe um tom revolucionário no que tange o tratamento do CA de mama e o prognóstico de muitos pacientes. Portanto, proporcionou a muitas pacientes em sonhar com a cura desta tão avassaladora doença.
O desenvolvimento tecnológico revolucionou o tratamento de inúmeras doenças, incluindo o câncer de mama. É impressionante como hoje pode ser discutida a cronificação de uma doença muito vista como uma sentença de morte no passado. Apesar de o prognóstico ainda ser reservado, o uso da nanotecnologia para o desenvolvimento de novas terapias traz perspectivas encorajadoras para o futuro do tratamento do câncer de mama, com aumento da sobrevida, melhora da qualidade de vida e, talvez, com o tempo, uma cura.
Acredito que a evolução dos tratamentos para neoplasias avançaram bastante nos últimos anos, o que, felizmente tem mudado desfechos e proporcionado ganhos de vida com qualidade ao paciente. Algo que ainda me deixa desconfortável diante de tantas novidades benéficas com as terapias mais avançadas é a discrepância de investimentos em novos tratamentos versus o quanto se poderia evitar com maiores investimentos em prevenção.
Com as diferentes terapias oferecidas, o câncer de mama, apesar de sua alta incidência, não deve mais ser considerado hoje uma sentença de morte. A partir do avanço e do maior desenvolvimento de tratamentos com nanotecnologia, a medicina parece caminhar para uma realidade em que a doença avançada pode ser curável.
A cronificação do câncer de mama avançado HER2-positivo é um avanço significativo no tratamento do câncer de mama. O fato de que muitos pacientes podem agora viver com qualidade de vida por muitos anos é uma excelente notícia. No entanto, é importante lembrar que a cronificação não significa a cura da doença e que o tratamento deve ser continuado para manter a condição sob controle. Além disso, o acesso aos tratamentos de terapia alvo e imunoterapia é fundamental para garantir que mais pacientes possam se beneficiar dessa abordagem. É necessário, portanto, que as políticas públicas de saúde incluam esses tratamentos em suas opções terapêuticas.
Os avanços na compreensão da biologia molecular do câncer de mama e o desenvolvimento de novas terapias têm mudado o prognóstico da doença; pacientes que anteriormente encaravam uma sentença de morte agora convivem com uma doença crônica, com possibilidade de tratamento prolongado e aumento da sobrevida. No entanto, apesar desses avanços, o câncer de mama ainda é responsável por milhares de mortes. A ciência continua empenhada em desenvolver terapias que buscam alterar a história natural da doença e aumentar a sobrevida global. Embora a cura ainda não seja garantida, o progresso é evidente e traz esperança para pacientes e suas famílias.
Com o avanço tecnológico ao longo do tempo, houve melhora significativa no tratamentos de neoplasias, incluindo o câncer de mama. A cronicidade do câncer de mama avançado HER-2 positivo significa que a doença não pode ser completamente curada, mas pode ser gerenciada como uma condição crônica a longo prazo. Isso é possível graças ao avanço das terapias-alvo, que visam especificamente a proteína HER-2 nas células cancerosas, bem como à quimioterapia e à radioterapia. No entanto, é importante ressaltar que cada caso é único e que o tratamento adequado dependerá de uma série de fatores, incluindo o estágio da doença, o tamanho e a localização do tumor, bem como a idade e a saúde geral da paciente. Por isso, é fundamental que a paciente trabalhe em estreita colaboração com sua equipe médica para desenvolver um plano de tratamento personalizado que melhor atenda às suas necessidades individuais.
Terapias como o duplo bloqueio com pertuzumab e trastuzumab na neoplasia de mama com superexpressão de HER-2 trouxeram novas esperanças na área de combate ao câncer, atribuindo para essa doença um caráter cada vez mais crônico e menos letal (embora, nesse caso, a progressão ainda ocorra mesmo após tal terapia). Para esse tratamento em específico, parece que a nanotecnologia com conjugado anticorpo-droga é promissora em termos de mudança da história natural da doença, sendo ainda necessários estudos com seguimentos mais longos para que se possa ter uma verdadeira noção de seu efeito.
Faça o login para escrever seu comentário.
Se ainda não possui cadastro no Portal Conexão Anticâncer, registre-se agora.